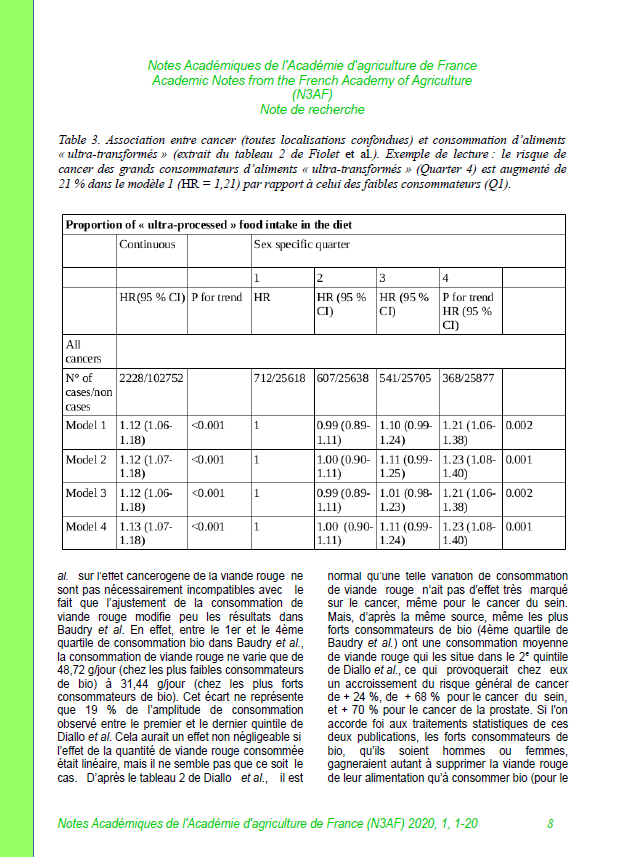
L’effet du sel et du sucre sur la fermentation
Suite à des textes qui indiquent que le sel et/ou le sucre bloquent la fermentation par des levures, nous décidons de faire une expérimentation qui compare un mélange d’eau, de farine et de levure, avec :
- le même mélange additionné d’un peu de sel
- le même mélange additionné de beaucoup de sel
- le même mélange additionné d’un peu de sucre
- le même mélange additionné de beaucoup de sucre.
Cette expérience est effectuée avec de la levure fraîche, achetée le jour même chez le boulanger local, et avec de la levure boulangère instantanée Francine (date limite d’utilisation mars 2022).
Tout est pesé sur une balance à 0.0001 g.
Pour les expériences, le mélange initial, qui est donc réparti dans 10 béchers, est composé de :
- 200.0 grammes d’eau désionisée
- 40.0 grammes de farine
On prévoir d’ajouter selon les cas : 20.0 grammes de levure fraîche ou 5 g de levure instantanée (1 sachet).
Pour le sel, la « petite » quantité est 4.0 g (c’est déjà beaucoup) ; et la grande quantité est quatre fois supérieure (16 g, considérable!)
Idem pour le sucre.
L’expérience commence en début de séminaire :
A 16 h 12, de la levure fraîche (20.0 g) est ajoutée à un bécher contenant la moitié du mélange eau+farine initial, soit 100 g d’eau et 20 g de farine, tandis que la levure lyophilisée est ajoutée à un autre bécher, où l’on a mis l’autre moitié du mélange eau+farine initial.
Puis, aussitôt (~ 30 s), on ajoute :
- rien dans les béchers B1 et B6
- 4 g de sel dans les béchers B2 et B7
- 16 g de sel dans les béchergs B3 et B8
- 4 g de sucre dans les béchers B4 et B9
- 16 g de sucre dans les béchers B5 et B10
Un bécher de contrôle B0 contenant 20 g d’eau, 4 g de farine et 2 g de levure fraîche avait mis sur un radiateur très chaud : comme on ne voit pas de fermentation, on décide que les béchers B1..10 seront seulement placés à côté du radiateur, et pas dessus.
A intervalles réguliers, on observe les fermentations, et les résultats sont sans appels :
- c’est avec le plus de sel (16 g!) que l’on a la mousse la plus abondante, dans un premier temps,
- c’est avec le plus de sucre (16 g) que l’on a ensuite la mousse la plus abondante.
Les images suivantes montrent l’état des béchers à 17 h 51 (ordre 1 : ni sel ni sucre ; 2 : peu de sel ; 3 : peu de sucre ; 4 beaucoup de sel ; 5 beaucoup de sucre). Centre International de gastronomie moléculaire AgroParisTech-Inrae
1. Pour la levure fraîche :
Et pour la levure lyophilisée :
Pour comparer, l’image des dix béchers prise à 18h 10 :
On voit bien que, pour la levure fraîche, le maximum de mousse est obtenu pour beaucoup de sucre, alors que c’est avec beaucoup de sel qu’il est maximal pour la levure lyophilisée.
Surtout, on signale que le classement par ordre de volume de mousse décroissants a toujours été :
- soit beaucoup de sel, soit beaucoup de sucre
- soit beaucoup de sucre, soit beaucoup de sel
- et les autres, ensuite, avec les béchers sans sel ni sucre en dernier du classement.
Pour interpréter, Grégory Schmauch envoie l’article Marina Carcea, Valentina Narducci, Valeria Turfani and Francesco Mellara. 2020. A Comprehensive Study on the Influence of Sodium Chloride on the Technological Quality Parameters of Soft Wheat Dough, Foods, 9(7), 925. https://www.mdpi.com/2304-8158/9/7/952, dernier accès 2021-01-19, dont le résumé est :
This study aimed at understanding how the presence or absence of NaCl influences dough rheological performance of soft wheat cvs. currently used in the Italian bread manufacturing industry as a scientific support to national health strategies to reduce the use of NaCl in bread. For this reason 176 flour samples belonging to 41 soft wheat cvs. currently cultivated in Italy, were analyzed for their protein content, Zeleny sedimentation value, and by means of the Chopin Alveograph and Brabender Farinograph, with no salt and with 1.5% salt addition (average salt content in Italian bread). Three selected cvs. (Aubusson, Bolero, and Blasco) were additionally studied by means of the Rapid Visco Analyzer (RVA) at three levels of salt addition (0%, 1.5% and 3.0%). The fermentation behaviour of the cvs. Aubusson and Blasco was also studied by means of a Rheofermentometer under the same conditions. The results of our study confirmed the role of salt in strengthening the wheat gluten network (up to 86%), and thus the gas retention of dough and in affecting yeast activity. However, it also definitely proved that careful cultivar selection can help in overcoming technical challenges in reduced-salt bread manufacturing and eventually, it opens the path to wheat breeding for reduced-salt bread baking.
Traduction personnelle : Cette étude montre comment la présence ou l’absence de NaCl influence les performances rhéologiques de la pâte faite de blé tendre couramment utilisée dans l’industrie boulangère italienne, dans une perspective de réduction nationale du sel dans le pain. Pour cela, 176 échantillons de farine de 41 variétés de blé tendre couramment cultivées en Italie ont été analysée : on a mesuré leur teneur en protéines, la valeur de sédimentation de Zeleny, et les données de l’alvéographe de Chopin et du farinographe de Brabender, sans sel ou avec une addition de 1,5 % de sel (la moyenne pour le pain italien). Trois variétés (Aubusson, Bolero et Blasco) ont été étudiés par Centre International de gastronomie moléculaire AgroParisTech-Inrae
l’analyseur rapide Visco (RVA) à trois niveaux d’ajout de sel (0 %, 1.5 %, 3%). Les comportements en fermentation des variétés Aubusson et Blasco ont été également étudiées par Rhéofermentomètre, dans les mêmes conditions. Les résultats confirment le rôle du sel dans le renforcement du réseau de gluten (jusqu’à 86%), et donc la rétention de gaz dans la pâte et l’activité des levures. Toutefois il est définitivement prouvé qu’une sélection soigneuse des cultivar peut aider à résoudre les difficultés techniques de l’industrie boulangère, dans sa recherche de réduction du sel, et conduire à des variétés nécessitant moins de tel]
Cet article est très critiquable, de nombreux points de vue (et rien que le résumé le montre bien), mais il montre que l’ajout de sel diminue la quantité de gaz produite, et aussi la quantité de gaz qui s’échappe par la suite.
A noter qu’ils ajoutent le sel à une pâte, et pas à une solution, comme dans nos expérience, et qu’ils signalent une diminution pour une teneur en sel de 3 %, plus grande que pour 1.5 %.
D’autre part, on peut s’interroger sur la différence entre :
- du sel ou du sucre ajoutés à un mélange liquide de démarrage de la fermentation
- du sel ou du sucre ajoutés directement à une pâte.
On observe que du sucre ajouté à une pâte conduit à l’ « effet sucre », de sorte que le sucre se trouve dilué dans un sirop, exactement comme dans notre expérience.
Pour du sel, il reste à tester un « effet sel », pour savoir si le sel reste présent sous la forme de grains solides, ou bien s’il est dilué dans de l’eau, auquel cas on se ramènerait à nos expériences (on regardera aussi au microscope).
Centre International de gastronomie moléculaire AgroParisTech-Inrae